リンパ脈管筋腫症(LAM)は、平滑筋様のLAM細胞が肺や体軸リンパ節などで増殖し、肺に多発性嚢胞を形成する、緩徐進行性かつ全身性の難治性疾患である。結節性硬化症(tuberous sclerosis complex ; TSC)に伴って発生するTSC-LAMと、単独で発生する孤発性LAMとに分類される。主として妊娠可能年齢の女性に発症し、進行に伴って労作時呼吸困難、咳嗽、血痰、乳び胸水などの症状や所見を認める。自然気胸を反復することが多く、女性自然気胸の重要な基礎疾患のひとつである。腎臓などに血管筋脂肪腫(病理学的に平滑筋様細胞のほか脂肪細胞と血管成分とを含む)を合併することがある。肺病変が進行すると呼吸機能が低下し呼吸不全を呈するが、進行の速さは症例ごとに多様であり、年余にわたり肺機能が保たれる症例もある。
本疾患は1940年前後から症例報告がみられ、1968年、Frackらによりpulmonary lymphangiomyomatosisという疾患名が用いられ、1977年、Carringtonらによりpulmonary lymphangioleiomyomatosisという疾患名が用いられた。本邦では、1970年、山中、斎木が 2例の剖検例と1例の開胸肺生検例を検討し、「び慢性過誤腫性肺脈管筋腫症」として報告したのが最初である。現在では lymphangioleiomyomatosisに統一されており、厚生労働省難治性疾患克服・政策研究事業ではリンパ脈管筋腫症となった。
まれな疾患であるため有病率や罹患率などの正確な疫学データは得られていない。平成15年度と18年度に厚生労働省難治性疾患克服研究事業「呼吸不全に関する調査研究班」(以下研究班)で全国の医療施設を対象とした2回の疫学調査が行われ、264人の患者情報が集まり検討された。その結果、本邦でのLAMの有病率は100万人あたり約1.9~4.5人と推測されている。米国などからの報告でも人口100万人あたり2~5人と推測されている。平成21年度からLAMは特定疾患治療研究事業の対象疾患となっているが、平成25年度のLAMの医療受給者数は586人であった。
一方、TSCに合併するLAM患者数に関しては、TSC女性症例の肺の26~40%にのう胞性変化(肺LAM)を認めると報告されており、本邦のTSC-LAM患者数は2,000~4,000人と推測されている。
LAMはTSC-LAMと孤発性LAMに分類されるが、両者ともTSCの原因遺伝子として同定されたTSC 遺伝子の異常が発症に関与している。TSCは全身の臓器に種々の過誤腫を形成する遺伝性疾患であるが、原因遺伝子としてTSC1(第9染色体)とTSC2(第16染色体)が同定されている。TSC1とTSC2はいずれもKnudsonの“2-hit theory”で説明される腫瘍抑制遺伝子と理解され、それぞれは蛋白質ハマルチン(Hamartin)と蛋白質ツベリン(Tuberin)をコードしている。両蛋白質は結合して複合体となり、細胞内シグナル伝達系として知られるAkt経路において、Rhebと呼ばれる低分子量G蛋白質を介してラパマイシン標的蛋白質(mammalian target of rapamycin ; mTOR)を抑制し、細胞の増殖や成長を調節している。そのため、TSC1またはTSC2の遺伝子変異によりハマルチン/ツベリン複合体が機能を失うと、恒常的にmTORが活性化された状態となり過剰な細胞増殖などにつながる。TSCでは先天的にTSC1またはTSC2のいずれかで片方の対立遺伝子の変異を有しており、後天的にもう片方の対立遺伝子にも変異が生じることによって腫瘍病変が出現すると考えられている。一方、孤発性LAM は体細胞においてTSC2 遺伝子変異(2-hit)が生じることにより発生すると考えられている。
TSC 遺伝子異常により形質転換した LAM 細胞は、病理形態学的には癌と言える程の悪性度は示さないがリンパ節や肺に転移し、肺にはびまん性、不連続性の病変を形成すると考えられている。また、LAM細胞はリンパ管内皮細胞増殖因子であるVEGF-CおよびVEGF-Dを強く発現し、LAM病変内には豊富なリンパ管新生を伴っており、LAM病変の進展や転移にリンパ管新生が中心的役割を担っている可能性が考えられている。
主に妊娠可能年齢の女性に発症し、平均発症年齢は30歳台中頃であるが、閉経後に診断されることもある。男性では、TSC-LAMの報告があるが、孤発性LAMは極めて稀である。肺病変の進行に伴い労作時呼吸困難が出現することにより、または自然気胸を契機として診断される場合が多いほか、無症状のまま胸部検診での異常影として発見される場合がある。その他の症状として咳嗽、血痰、喘鳴などの呼吸器症状や、乳び胸水または腹水、下肢のリンパ浮腫、腹部腫瘤(リンパ脈管筋腫、lymphangioleiomyoma)、腎血管筋脂肪腫に伴う症状(腹痛、血尿、貧血など)を認める場合がある。
肺への嚢胞形成には、LAM細胞からのプロテアーゼの産生と活性化が関与すると考えられており、気胸は胸膜直下に生じた嚢胞が破綻することにより頻回に合併すると考えられる。乳び胸水や腹水は、リンパ路の障害やLAM病変を介することによる乳びの漏出によると考えられる。 聴診を含めた理学所見では、一般に特徴的なものはないが、TSCを合併している場合には、顔面の血管線維腫、爪囲線維腫、白斑などの皮膚病変を認めることがある。肺の高分解能CT画像は診断に非常に有用で、境界明瞭な薄壁を有する嚢胞(径数mm~1cm大が多い)が両肺野にびまん性に散在する像が特徴的である。胸部単純写真はCTに比べて感度が低く、正常、網状陰影、過膨張、胸水、等々の所見が病期に応じて認められる。肺機能検査では、肺拡散能の低下、閉塞性換気障害が最も多く認められる。腹部画像検査で腎血管筋脂肪腫やリンパ脈管筋腫(後腹膜腔や骨盤腔の腫瘤影)を認めることがある。
女性において肺の高分解能CT画像でLAMに特徴的な所見が得られ、臨床的にTSCの診断が得られるか(この場合、大症状としてのLAMを除外する)、血管筋脂肪腫、乳び胸水または腹水、リンパ脈管筋腫のいずれかの所見が伴う場合は臨床的にLAMの診断が可能であると考えられるが(Eur Respir J 2010 ; 35 : 14-26)、他の嚢胞性肺疾患の除外も注意深く行われなければならない。確定診断のためには経気管支肺生検や胸腔鏡下肺生検、あるいはリンパ節病変からの生検によるLAM細胞の確認が必要であるが、有用性とリスクを鑑みて手技を選択する必要がある。乳糜胸水や腹水中にはLAM細胞クラスターが検出され、LAMの診断が可能な場合がある。最近の研究により血清バイオマーカーとしてのVEGF-Dの有用性が報告されており、臨床的に利用できるようになれば、今後診断の一助となると思われる。
本邦における診断基準の詳細は、研究班による「リンパ脈管筋腫症 lymphangioleiomyomatosis(LAM)診断基準」を参照されたい(日本呼吸器学会雑誌46:425-427, 2008. 本ホームページからダウンロード可)。指定難病としてのLAMの診断基準は特定疾患での認定基準を踏襲している。臨床診断に必須項目のみの診断が含まれるため、厳密で注意深いCT読影および他の嚢胞性肺疾患の鑑別を要する。
近年、分子標的治療薬の一種でありmTOR阻害薬であるシロリムスの有効性が報告され、本邦において2014年7月に薬事承認された。シロリムスは、肺機能の低下を防止する、乳び胸水や腹水を減少させる、腎血管筋脂肪腫を縮小する、等の効果が報告されている。進行性に呼吸機能が低下する症例において、さらなる進行を防止する目的で第一選択となるが、どのような時期や状態で開始するのが最適であるかは検討課題として残されており、現時点では個々の状況による判断が必要である。基本的には長期投与となり、薬剤性肺障害、感染症、口内炎、皮疹、卵巣機能障害など多岐にわたる副作用への対応が必要であり、適切な医療体制のもとで処方を行う。閉塞性換気障害を認める症例では気管支拡張薬が症状改善に有用であり、作用機序の異なる薬剤を単独あるいは併用して投与する。本症の発症と進行には女性ホルモンの関与が推測されるため、ホルモン療法が考慮されてきたが、効果に関して一定の見解は得られていない。
LAMでは気胸の再発が多くみられるため、早期に胸膜癒着術や外科的治療を行い、再発防止策を講じる必要がある。酸化セルロースメッシュを使用した全肺胸膜カバリング術は、胸膜癒着を起こさずにLAMの気胸再発を予防できるため有用である。実施可能な施設では、再発を繰り返すLAM症例に推奨される治療である。乳び胸水や腹水、リンパ浮腫には、脂肪制限食、生活指導、利尿剤などの内科的治療で管理可能な場合があるが、これらでは管理困難な場合にはシロリムス投与が選択肢となる。腎血管筋脂肪腫では症状や出血のリスクに際して、泌尿器科、腎臓内科などの関連診療科と連携のうえ腎動脈塞栓術またはmTOR阻害薬投与を検討する。結節性硬化症では血管筋脂肪腫に対してmTOR阻害薬であるエベロリムスが承認されているため、TSC-LAMに合併した血管筋脂肪腫の治療ではエベロリムスが処方可能である。
肺病変の進行により呼吸不全に至った症例では呼吸リハビリテーションと酸素療法がCOPDなどの他疾患と同様に検討される。末期呼吸不全に対して肺移植が適応となるが、移植肺にLAMが再発し得ることが知られている。
妊娠、出産は患者にとって重要な課題であるが、病状が悪化する可能性がある。必ずしも禁忌とは言えないが、妊娠、出産がLAMの病勢へ及ぼす影響と、その時点でのLAMによる呼吸機能障害の程度、胎児に与える影響など総合的に考慮し慎重に考える必要がある。
乳び胸水または腹水に対しては脂肪制限食を基本とするほか、胸膜癒着術や腹腔静脈シャント留置などが必要となる場合がある。
臨床経過は多様であり、慢性に進行し呼吸不全に至る予後不良な症例もあれば、無治療でも進行が緩徐で長期間にわたり呼吸機能が良好に保たれる症例もある。しかし、LAMのうちどのくらいの割合が進行して重症化しやすいのか、明らかにはなっていない。
平成15・18年度に本邦で行われた全国調査の結果、10年予測生存率は85%であったが、横断的調査であり参考値である。米国LAM Foundationによる登録患者410症例からの解析の結果、10年生存率(移植なし)は86%と報告されている。予後を予測する因子として、肺の病理組織学的重症度やCTによる嚢胞性病変の定量評価、肺拡散能や1秒量などの呼吸機能に関する報告がなされている。上記の全国調査において、労作時の息切れを初発症状とする症例では自然気胸を初発症状とする症例に比して生存率が有意に低下していたが、過去に比して早期診断される傾向にある昨今においては一概にいえず、やはり症例毎の経過観察が重要と考えられる。高齢または閉経後において進行が緩徐であるとの報告もなされている。
診断確実例、診断ほぼ確実例、臨床診断例いずれも指定難病の対象とする。
リンパ脈管筋腫症(Lymphangioleiomyomatosis:LAM)は、平滑筋様細胞(LAM 細胞)が肺、体軸リンパ節(肺門・縦隔、後腹膜腔、骨盤腔など)で増殖して病変を形成し、病変内にリンパ管新生を伴う疾患である。通常、生殖可能年齢の女性に発症し、労作時息切れ、気胸、血痰などを契機に診断される。本症の診断には、 LAM に一致する胸部 CT 所見があり、かつ他の嚢胞性肺疾患を除外することが必須であり、可能であれば病理学的診断を行うことが推奨される。
- 1. 主要項目
- (1) 必須項目
- LAM に一致する胸部 CT所見(注2)があり、かつ他の嚢胞性肺疾患を除外できる。
- (2) 診断の種類:診断根拠により以下に分類する。
-
① 診断確実例:必須項目+病理診断確実例(注3)
② 診断ほぼ確実例
②-1 組織診断例:必須項目+病理診断ほぼ確実例(注3)
②-2 細胞診断例:必須項目+乳糜胸腹水中にLAM細胞クラスター(注4)を認めるもの
③ 臨床診断例
③-1 :必須項目+LAMを示唆する他の臨床所見(注5)
③-2 :必須項目のみ
- 2. 鑑別診断
- 以下のような肺に囊胞を形成する疾患を除外する。
- ・ブラ、ブレブ
- ・COPD (慢性閉塞性肺疾患)
- ・ランゲルハンス細胞組織球症(LCH)
- ・シェーグレン症候群に伴う肺病変
- ・アミロイドーシス(囊胞性肺病変を呈する場合)
- ・空洞形成性転移性肺腫瘍
- ・Birt-Hogg-Dubé 症候群
- ・リンパ球性間質性肺炎lymphocytic interstitial pneumonia (LIP)
- ・Light-chain deposition disease
- 3.指定難病の対象範囲
- 上記①②③いずれも対象とする。
- 但し、③ 臨床診断例の申請にあたっては臨床調査個人票の主治医意見欄に病理診断できない理由、結節性硬化症の診断根拠、穿刺検査で確認した乳糜胸水や乳糜腹水の合併、などの必要と思われる意見を記載すること。胸部 CT 画像(高分解能CT)も提出すること。
(注1)LAM は全身性疾患であるため、肺病変と肺外病変がある。肺外病変のみのLAM症例が診断される可能性は否定できないが、この LAM 認定基準では予後を規定する肺病変の存在を必須項目とする。
(注2)LAM に一致する胸部CT所見- 境界明瞭な薄壁を有する囊胞(数mm~1cm大が多い)が、両側性、上~下肺野に、びまん性あるいは散在性に、比較的均等に、正常肺野内に認められる。高分解能CT 撮影(スライス厚1~2mm)が推奨される。
- (注3)病理学的診断基準
- LAM の基本的病変は平滑筋様細胞(LAM細胞)の増生である。集簇して結節性に増殖する。病理組織学的にLAMと診断するには、このLAM細胞の存在を証明することが必要である。肺(囊胞壁、胸膜、細気管支・血管周囲など)、体軸リンパ節(肺門・縦隔、後腹膜腔、骨盤腔など)に主に病変を形成し、リンパ管新生を伴う。
- (1) LAM細胞の所見
- ① HE染色
- LAM細胞の特徴は、 ①細胞は紡錘形~細類上皮様形態を呈し、②核は類円形~紡錘形で、核小体は0~1個、核クロマチンは微細、③細胞質は好酸性もしくは泡沫状の所見を示す。
- ② 免疫組織化学的所見
- LAM 細胞は、抗α-smooth muscle actin(α-SMA)抗体・抗HMB45 抗体(核周囲の細胞質に顆粒状に染色)に陽性を示し、核は抗 estrogen receptor (ER)抗体・抗progesterone receptor (PR)抗体に陽性を示す。 LAM 細胞はこれらすべてに陽性となるわけではない。
- (2) LAM 細胞の病理学的診断基準
- 病理診断確実:
- (1) -①(HE染色所見)+ (1) -②のα-SMA(+)+ HMB45(+)
- 病理診断ほぼ確実:
- (1)-①(HE染色所見)+ (1) -②のα-SMA(+)+ HMB45 (− )かつ、
- ER か PR のいずれか一つでも陽性の場合。
(注4)LAM 細胞クラスターとは- 表面を一層のリンパ管内皮細胞で覆われた LAM 細胞集塊である。α-SMA・HMB45・ER・PR・D2-40(あるいは VEGFR-3)による免疫染色で確認する。
(注5)LAM を示唆する他の臨床所見とは、以下の項目をいう。- (1)結節性硬化症の合併
- 結節性硬化症の臨床診断は、日本皮膚科学会による結節性硬化症の診断基準及び治療ガイドライン(日皮会誌 118(9);1667-1676,2008)に準じる。
但し、「臨床診断例」の場合には LAM の病理診断や細胞診診断が得られていない状況であるため、LAM を除外した項目で結節性硬化症の臨床診断基準を満たすことが必要である。 - なお、LAMが主となる診断の場合と、結節性硬化症が主となる診断の場合の腎血管筋脂肪腫に対する治療適用基準には一定の見解が得られていないので、注意が必要である。
- (2)腎血管筋脂肪腫の合併(画像診断可)
- (3)穿刺検査で確認した乳糜胸水や乳糜腹水の合併
- (4)後腹膜リンパ節や骨盤腔リンパ節の腫大
(3)診断基準に関して留意すべきこと- LAMが2009年より特定疾患治療研究事業の対象疾患として追加認定されてより、公費負担対象患者の認定基準が運用され、指定難病におけるLAMの診断基準はこの認定基準の内容を踏襲している。この基準において、病理学的診断を行うことが推奨されている反面、外科的生検によるリスクが高い場合などを想定して、肺のCT画像所見と他の嚢胞性肺疾患を除外することによる、いわゆる必須項目のみによる診断が認められている。
- HRCT 撮影(スライス厚1~2mm)が推奨されており、HRCT画像において診断基準の注2に記載される特徴的な所見から診断率は高いとされる一方で、他の嚢胞性肺疾患と所見が類似し鑑別が難しい場合がある。CT画像の高度な読影能力が要求され、統一された厳密な審査を要する。特定疾患治療研究事業対象疾患 リンパ脈管筋腫症(LAM)認定基準の解説より抜粋の図を参照されたい。
図 LAMおよび鑑別すべき嚢胞性肺疾患の代表的画像- (林田美江、他:日呼吸会誌 2011; 49(2): 67-73解説改変)
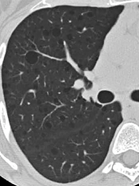
- A. LAMの通常条件での胸部CT(スライス厚10 mm)
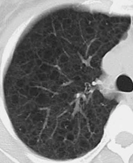
- B. Aと同一症例LAMの高分解能CT(スライス厚1 mm)
- スライス厚が通常条件(5~10mm)の画像では個々の嚢胞を鮮明に描出できないため、高度な肺気腫との鑑別が困難な場合がある。
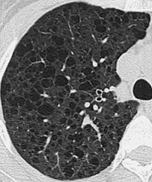
- C. LAM軽症例の胸部CT(スライス厚2 mm)
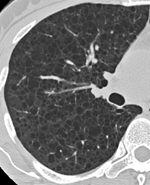
- D. LAM重症例の胸部CT(スライス厚2 mm)
- 嚢胞は軽症例では少なく、進行性に嚢胞の数が増加するが、進行例においても類円形の薄壁嚢胞の形状は変わらない。
- E. ブラ・ブレブの胸部CT(スライス厚2 mm)
- びまん性肺病変を伴わずに認める例もあるが、大小の嚢胞が肺尖や胸膜近くに好発する点から、画像上でも鑑別は容易である。
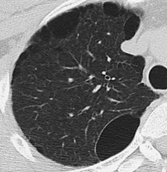
- F. COPDの胸部CT(スライス厚2 mm)
- 正常肺野と明瞭に識別される低吸収領域が多発している。嚢胞様にみえることもあるが、その形状は不整で、上肺野に多く、進行例では大小の融合した低吸収領域となる。
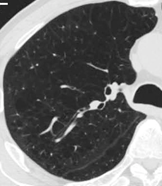
- G. ランゲルハンス細胞組織球症の胸部CT(スライス厚2 mm)
- 上肺野に類円型、あるいは不整形の嚢胞がみられるが、嚢胞壁の厚さが不均一である。また背景の肺野に小結節影、すりガラス影、線状影などがみられる。
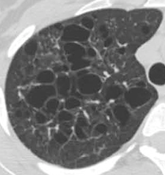
- H. Birt-Hogg-Dubé症候群の胸部CT(スライス厚2 mm)
- Birt-Hogg-Dubé症候群は肺の嚢胞形成を特徴とする遺伝性疾患であるが、反復性気胸や皮膚病変、腎腫瘍の合併をみることがあり、ときにTSC-LAMの臨床像に類似している。肺野のCT画像では嚢胞の数は少なく、下肺野や縦隔側に比較的偏って分布し、大小のばらつきが大きく、不整形の嚢胞が多いという点でLAMと鑑別され得る
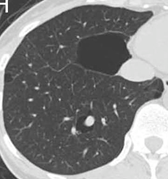
- I. Sjögren症候群の胸部CT
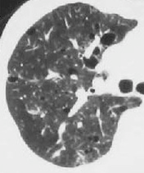
- J. Sjögren症候群、アミロイドーシス合併例の胸部CT
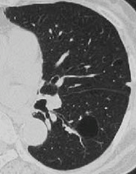
- Sjögren症候群、リンパ球性間質性肺炎、アミロイドーシスは、各々が併存あるいは合併する場合が多く、CT上しばしば嚢胞がみられる。しかし結節影や濃度上昇域、肺血管・気管支の肥厚といった所見を伴っており、嚢胞以外にそのような所見のないLAMとの鑑別点になる。
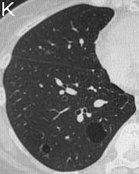
- K. 転移性肺腫瘍(化学療法後に空洞病変に変化した子宮体癌の肺転移)の胸部CT(スライス厚2.5 mm)
- 転移性肺腫瘍の結節が空洞化し嚢胞状にみえる場合がある。しかし嚢胞壁の厚さが不整であったり、壁が厚く嚢胞というより空洞と認識できることが多く、LAMと鑑別される。結節性陰影であったものが化学療法後に薄壁嚢胞を形成することがあり、治療歴や陰影の変化に注意を要する。
重症度分類
重症度分類Ⅱ以上を対象とする。
| 【重症度分類】 ★重症度Ⅰ~Ⅳとし、一つ以上の項目を満たす最も高い重症度を採用する。 | ||||||
| 呼吸機能障害 | 気胸 | 腎血管筋脂肪腫 | 乳び胸水・腹水・リンパ浮腫 | リンパ脈管筋腫 | ||
| Ⅰ | 80Torr≦PaO2 | 80%≦%FEV1 | 1年以内の気胸発症は左記の呼吸機能障害の段階を一つ上げる | 4cm未満、かつ症状や動脈瘤(径5mm以上)を認めない | 症状を有さないリンパ脈管筋腫 | |
| Ⅱ | 70Torr≦PaO2<80Torr | 70%≦%FEV1<80% | 4cm以上であるが、症状や動脈瘤(径5 mm以上)を認めない | 内科的管理*によりコントロールされている(*脂肪制限食、生活指導、利尿剤など) | 症状を有するリンパ脈管筋腫 | |
| Ⅲ | 60Torr≦PaO2<70Torr | 40%≦%FEV1<70% | 大きさに関係なく症状*を認める(*背部痛、腹痛、血尿など)、あるいは径5 mm以上の動脈瘤を認める | 内科的管理*によりコントロールが困難(*脂肪制限食、生活指導、利尿剤など) | ||
| Ⅳ | PaO2<60Torr | %FEV1<40% | 動脈瘤破裂により腫瘍内外に出血を認める | |||
※なお、症状の程度が上記の重症度分類等で一定以上に該当しない者であるが、高額な医療を継続することが必要な者については、医療費助成の対象とする。
本症の病状や進行速度には個人差があり、個々の症例に応じた治療方針の決定が必要である。無治療でも肺機能や画像所見の著しい悪化を認めない症例もある。症状や合併症を認める場合はそれに対する治療を行う。近年、分子標的治療薬の一種でありmTOR阻害薬であるシロリムスの有効性が報告され、本邦において2014年7月に薬事承認された。シロリムスは、肺機能の低下を防止する、乳び胸水や腹水を減少させる、腎血管筋脂肪腫を縮小する、等の効果が報告されている。進行性に呼吸機能が低下する症例において、さらなる進行を防止する目的で第一選択となるが、どのような時期や状態で開始するのが最適であるかは検討課題として残されており、個々の状況による判断が必要である。基本的には長期投与となり、薬剤性肺障害、感染症、口内炎、皮疹、卵巣機能障害など多岐にわたる副作用への対応が必要であり、適切な医療体制のもとで処方を行う。閉塞性換気障害を認める場合、β2刺激薬や抗コリン薬などの気管支拡張薬が有効なことがあり、単独あるいは併用して投与する。本症の発症と進行には女性ホルモンの関与が推測されるため、経時的に肺機能が悪化する症例では、性腺刺激ホルモン放出ホルモン(Gonadotropin releasing hormone, GnRH)やプロゲステロン製剤などの投与によるホルモン療法が考慮される。しかし、ホルモン療法の効果に関して一定の見解はなく、慎重に対応を行う。
LAMでは気胸の再発が多くみられるため、早期に胸膜癒着術や外科的治療を行い再発防止策を講じる必要がある。胸膜癒着術を行った場合、将来的に肺移植が必要となったときに、癒着剥離による手術時間の延長や出血量の増加が起こり得るが、癒着術の既往が肺移植の適応外となることはない。酸化セルロースメッシュを使用した全肺胸膜カバリング術は、胸膜癒着を起こさずにLAMの気胸再発を予防できるため有用である。実施可能な施設では、再発を繰り返すLAM症例に推奨される治療である。腎血管筋脂肪腫は基本的には経過観察を行うが、出血のリスクに関して関係診療科と連携のうえ判断を行う。結節性硬化症では血管筋脂肪腫に対してmTOR阻害薬であるエベロリムスが承認されているため、TSC-LAMに合併した血管筋脂肪腫の治療では、動脈塞栓術の他にエベロリムスが処方可能である。 肺病変の進行により呼吸不全に至った症例では呼吸リハビリテーションと酸素療法がCOPDなどの他疾患と同様に検討される。末期呼吸不全に対して肺移植が適応となるが、移植肺にLAMが再発し得ることが知られている。治療の詳細に関しては、研究班による「リンパ脈管筋腫症 lymphangioleiomyomatosis(LAM)の治療と管理の手引き」を参照されたい。
- 1. 林田美江、他. リンパ脈管筋腫症lymphangioleiomyomatosis(LAM)診断基準. 日呼吸会誌 2008;46(6):425-427.
- 2. 林田美江、他. リンパ脈管筋腫症lymphangioleiomyomatosis(LAM)治療と管理の手引き. 日呼吸会誌 2008;46(6):428-431.
- 3. 林田美江、他. 特定疾患治療研究事業対象疾患 リンパ脈管筋腫症lymphangioleiomyomatosis(LAM)認定基準の解説. 日呼吸会誌2011;49(2):67-73.
- 4. リンパ脈管筋腫症(LAM)ATS/JRS(日本呼吸器学会)の診療ガイドライン McCormack FX, et al; ATS/JRS Committee on Lymphangioleiomyomatosis. Official American Thoracic Society/Japanese Respiratory Society Clinical Practice Guidelines: Lymphangioleiomyomatosis Diagnosis and Management. Am J Respir Crit Care Med. 2016;194(6):748-61.
- 5. 林田美江、安藤克利、関谷充晃、瀬山邦明 、井上義一、巽浩一郎、厚生労 働省難治性疾患政策研究事業 呼吸不全に関する調査研究班. LAMを有する成人女性においてmTOR阻害薬は第一選択となりますか?日呼吸会誌 016;5(4):166-171.
- 6. Hayashida M, et al. Reductions in pulmonary function detected in patients with lymphangioleiomyomatosis. An analysis of the Japanese National Research Project on Intractable Diseases database. Respiratory Investigation 54:193-200,2016.
- 7. Takada T, et al. Efficacy and safety of long-term sirolimus therapy for Asian patients with lymphangioleiomyomatosis. Ann Am Thorac Soc 13(11): 1912-22,2016.
- 8. Ando K, et al. Lung transplantation for lymphangioleiomyomatosis in Japan. PLos One 11(1): e0146749, 2016.
注:本文中の「TSC」は、病名を指す場合はTSC、遺伝子名を指す場合はTSC(イタリック体)で表記しています。
